ALDEHÍDOS
La palabra aldehído proviene
del latín científico alcohol dehydrogenatum que significa alcohol deshidrogenado. En este sentido, los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional –CHO. A diferencia de los demás grupos funcionales que contienen un grupo carbonilo C=O, los aldehídos sólo están unidos a un radical y por otro enlace, a un hidrógeno.
ESTRUCTURA
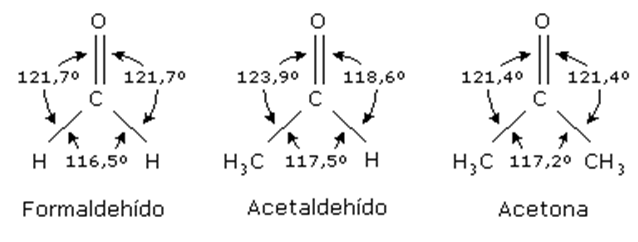
La geometría de los aldehídos es trigonal plana pues su carbono principal posee hibridación con 3 orbitales atómicos sp2 y 1 orbital p. Estos orbitales atómicos unidos con los orbitales atómicos de los demás carbonos son 1sp2-s, con el hidrógeno, 1sp2-sp2 y 1p-p, ambos con el oxígeno y por último, 1sp2-sp3, con el radical. Como consecuencia, los aldehídos tienen 3 enlaces sigma y un enlace pi. Así, los ángulos que forman los enlaces del carbono con los tres átomos enlazados son aproximadamente de 120.
PROPIEDADES FÍSICAS
Los primeros aldehídos de la clase presentan un olor picante y penetrante, fácilmente distinguible por los seres humanos. El punto de ebullición de los aldehídos es en general, mas alto que el de los hidrocarburos de peso molecular comparable; mientras que sucede lo contrario para el caso de los alcoholes, así, el acetaldehído con un peso molecular 44 tiene un punto de ebullición de 21°C, mientras que el etanol de peso 46 hierve a 78°C.
La solubilidad en agua de los aldehídos depende de la longitud de la cadena, hasta 5 átomos de carbono tienen una solubilidad significativa como sucede en los alcoholes, ácidos carboxílicos y éteres. A partir de 5 átomos la insolubilidad típica de la cadena de hidrocarburos que forma parte de la estructura comienza a ser dominante y la solubilidad cae bruscamente.
PROPIEDADES QUÍMICAS
Las reacciones químicas de los aldehídos son función del grupo carbonilo. Caracterizado por su alta electronegatividad, el oxígeno atrae el par electrónico más hacia él alejándolo del carbono. Po esta razón, la distribución electrónica del enlace no resulta simétrica; el oxígeno es ligeramente negativo y el carbono ligeramente positivo. Al adicionar reactivos al doble enlace carbono-oxígeno, se observa que la parte positiva del reactivo siempre es atraído por el oxígeno, y el fragmento negativo se une al carbono.
- Oxidación
Para oxidar los aldehídos a ácidos orgánicos, puede utilizarse cualquier agente oxidante como el KMnO4 (permanganato de potasio y el K2Cr2O7 (dicromato de potasio). Dos ejemplos de reacciones de oxidación de aldehídos son: la oxidación de butiraldehído a ácido butírico y la oxidación de benzaldehído a ácido benzoico.
- Reducción a alcoholes
Por contacto con hidrógeno en presencia de ciertos catalizadores el doble enlace C=O del grupo carbonilo se rompe y un átomo de hidrógeno se acopla a uno de los enlaces para formar el grupo hidroxilo típico de los alcoholes.
- Reducción a hidrocarburos
Los aldehídos pueden ser reducidos a hidrocarburos al interactuar con ciertos reactivos y en presencia de catalizadores. En la reducción Wolff-Kishner el acetaldehído se trata con hidrazina como agente reductor y etóxido de sodio como catalizador. El resultado de la reacción produce una mezcla de etano, agua y nitrógeno.
- Polimerización
Los primeros aldehídos de la clase tienen un marcada tendencia a polimerizar. El formaldehído por ejemplo, polimeriza de forma espontánea a temperatura ligeramente superior a la de congelación (-92°C).
Del mismo modo, cuando se evapora una solución al 37% de formaldehído en agua que contenga de 10 a 15% de metanol se produce un polímero sólido que se conoce como parafolmaldehído. Si se calienta el parafolmaldehído se vuleve a producir el formaldehído en forma gaseosa.
También se forman polímeros cuando las soluciones de formaldehído o acetaldehído se acidifican ligeramente con ácido sulfúrico.
- Reacciones de adición
Los aldehídos también sufren reacciones de adición, en las cuales se rompe la estructura molecular del aldehído y el agente reaccionante se agrega a la molécula para la formación de un nuevo compuesto.
OBTENCIÓN NATURAL
Los aldehídos se encuentran ampliamente presentes en la naturaleza, pues como se ampliará próximamente en los usos de los aldehídos, los aromas de las frutas, canela, vainilla, verduras, plantas, arboles e incendios se dan por este grupo funcional. Además, cabe resaltar que el carbohidrato glucosa es un aldehído llamado polihidroxialdehído.
USOS GENERALES
Los aldehídos están presentes en numerosos productos naturales y grandes variedades de ellos son de la propia vida cotidiana. La glucosa por ejemplo existe en una forma abierta que presenta un grupo aldehído. El acetaldehído formado como intermedio en la metabolización se cree responsable en gran medida de los síntomas de la resaca tras la ingesta de bebidas alcohólicas.
El aldehído fórmico, también conocido como metanal, es utilizado fundamentalmente en la industria para la obtención de resinas fenólicas y alquídicas, junto con la elaboración de explosivos como el pentaeritrol y el tetranitrato de pentaeritrol (TNPE). Además, este producto también se utiliza para obtener poliuretano expandido.
- Plásticos:
 La elaboración de plásticos termoestables como la bakelita, se da gracias a la intervención del formaldehído. Además, los aldehídos se usan en las industrias mecánicas para la elaboración de plásticos técnicos que sustituyen las piezas metálicas en los automóviles y en la maquinaria. Del mismo modo, estos plásticos obtenidos también son utilizados como cubiertas resistentes a choquen en aparatos eléctricos.
La elaboración de plásticos termoestables como la bakelita, se da gracias a la intervención del formaldehído. Además, los aldehídos se usan en las industrias mecánicas para la elaboración de plásticos técnicos que sustituyen las piezas metálicas en los automóviles y en la maquinaria. Del mismo modo, estos plásticos obtenidos también son utilizados como cubiertas resistentes a choquen en aparatos eléctricos.- Perfumería:
 Uno de los usos más comunes de los aldehídos es el que se le da en la industria de la perfumería puesto que ellos se encuentran en gran medida en las fragancias de las frutas y las flores. Por esta cualidad, los aldehídos se utilizan no sólo para la creación de fragancias sino también para la fijación de la misma. Compuestos como el benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela), la vainillina (saborizante principal de la vainilla), aportan a la creación de diferentes fragancias. Por otro lado, la muscona y la civetona son utilizados para fijar los aromas, evitando su evaporación.
Uno de los usos más comunes de los aldehídos es el que se le da en la industria de la perfumería puesto que ellos se encuentran en gran medida en las fragancias de las frutas y las flores. Por esta cualidad, los aldehídos se utilizan no sólo para la creación de fragancias sino también para la fijación de la misma. Compuestos como el benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela), la vainillina (saborizante principal de la vainilla), aportan a la creación de diferentes fragancias. Por otro lado, la muscona y la civetona son utilizados para fijar los aromas, evitando su evaporación.
No es raro pensar que el más importante de los aldehídos en términos de industria, sea el formaldehído pues sus usos van desde la formación de plásticos hasta la desinfección. Sin embargo, a pesar de poseer otras utilidades en la industria textil, es ampliamente utilizado en su solución acuosa. Ésta recibe el nombre del conocido formol o formalina y es comúnmente utilizado para la preservación de tejidos ante la descomposición. A continuación es mostrado mediante las imágenes los diferentes usos de este producto.
Los usos principales de los aldehídos son:
- La fabricación de resinas
- Plásticos
- Solventes
- Pinturas
- Perfumes
- Esencias
- Los dos efectos más importantes de los aldehidos son: narcotizantes e irritantes.
- Los principales efectos del formaldehido son: irritación de las vías respiratorias y ojos y dermatitis (las resinas). El NIOSH lo ha propuesto como potencialmente cancerígeno (ca. nasal en ratas).
- Los efectos nocivos del furfural son, fundamentalmente: irritativos respiratorios, dérmicos y oculares (a temperatura ambiente, presenta un riesgo limitado de toxicidad).
- El principal riesgo de la vainilla es: la dermatitis que produce en los trabajadores que la cultivan (en algunos países está considerada como enfermedad profesional).
- Los principales efectos del formaldehido son: irritación de las vías respiratorias y ojos y dermatitis (las resinas). El NIOSH lo ha propuesto como potencialmente cancerígeno (ca. nasal en ratas).
- Dos fuentes importantes de exposición a la acroleina son: el humo del tabaco (cáncer de pulmón) y el uso de aceites recalentados (tumores digestivos).
- El principal efecto de la acroleina es: irritación muy grave de vías respiratorias (de efectos irrecuperables) y cutánea.
- El acetaldehido se comporta como: irritante de mucosas y membranas, actuando también como narcótico sobre el SNC.
- La intoxicación crónica por acetaldehido es: similar a la del alcoholismo crónico.
- La exposición repetida a vapores de acetaldehido causa: dermatitis y conjuntivitis.

BIBLIOGRAFIA:
- http://organicamentefuncional.blogspot.com/2013/05/aldehidos.html
- http://maescentics.medellin.unal.edu.co/~lnmayao/index.php/Aldeh%C3%ADdos_y_Cetonas
- http://quimicaparatodos.blogcindario.com/2009/09/00066-los-aldehidos.html
- http://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
- http://aldehidosycetona.blogspot.com/2010/08/usos-aldehidos-y-cetonas.html
- http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_aldehidos_cetonas.htm
- http://cta4b94.wordpress.com/aldehidos-y-cetonas/
- http://www.elergonomista.com/aldehidos.htm


















.jpg)
.jpg)
.jpg)


.jpg)

.jpg)

.jpg)





.jpg)
.jpg)
